TIANcombi DNA Lyse & Det PCR Kit
Funksjoner
■ Enkelt og raskt: DNA fra forskjellige vev kan ekstraheres på 5 minutter uten behov for flytende nitrogensliping.
■ Brede bruksområder: Gjelder planteblader, frø, dyrevev, blodprøver (ferskt blod, antikoagulasjon, blodpropper, tørkede blodflekker, etc.), gjær og bakterier.
■ Sterk kompatibilitet: PCR -reagenset er egnet for amplifikasjon av DNA ekstrahert fra forskjellige prøvekilder.
applikasjoner
■ Gendeteksjon: Ideelt valg for storskala genpåvisning.
Viktige notater
■ For prøver som inneholder høye nivåer av fenoler, for eksempel bomullsblader, bør mengden av prøver være mindre enn 0,4 mg, ellers påvirkes PCR -reaksjonen.
Alle produktene kan tilpasses for ODM/OEM. For detaljer,vennligst klikk på Tilpasset service (ODM/OEM)
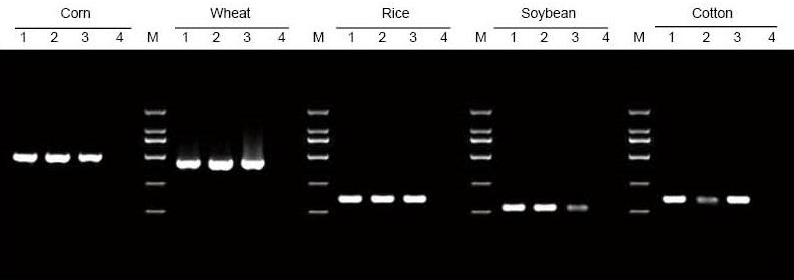 |
DNA ble ekstrahert fra henholdsvis 5 mg av bladene og frøene av mais, hvete, ris, soyabønner og bomull. DNA ble amplifisert ved PCR ved bruk av spesifikke primere. 6 ul DNA fra de totale 20 ul eluentene ble lastet per kjørefelt. 1: Positivt kontrollgenom; 2: la prøver; 3: frøprøver; 4: NTC; 5: D2000 primere |
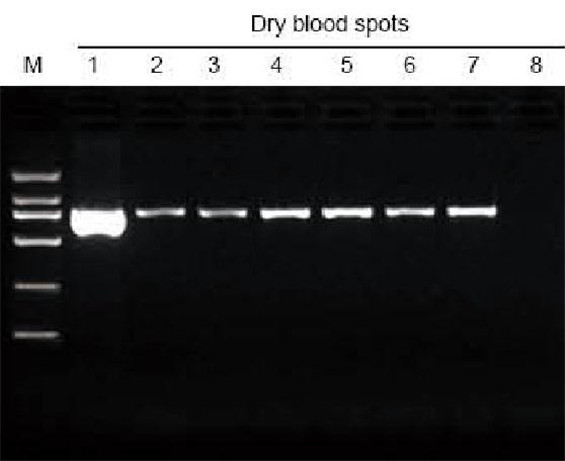 |
M: TIANGEN Marker D2000; 1: Positiv kontroll; 2-7: Antall tørkede blodflekker på filterpapiret er henholdsvis 1-6; 8: Negativ kontroll. 3 mm hullemaskinen ble brukt til å ta de tørkede blodflekkene fra filterpapiret som materiale for ekstraksjonstesten. 6 ul DNA fra de totale 20 ul eluentene ble lastet per kjørefelt. |
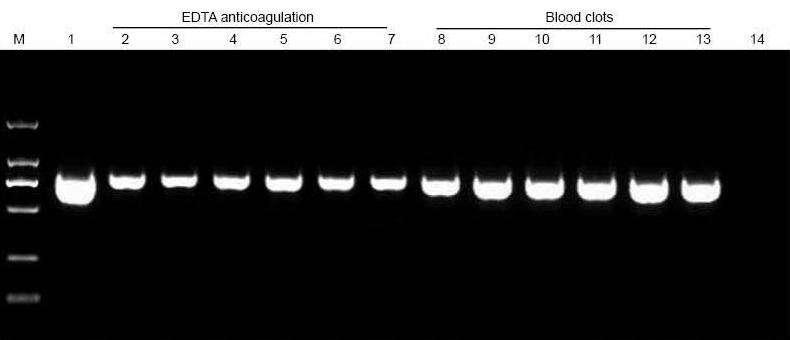 |
M: TIANGEN Marker D2000; 1: Positiv kontroll (genomisk DNA ble brukt som mal); 2-7: Mengden blod tilsatt er henholdsvis 10 μl, 20 μl, 30 μl, 40 μl, 50 μl og 60 μl; 8-13: Mengden blod tilsatt er henholdsvis 10 ul, 20 ul, 30 ul, 40 ul, 50 ul og 60 ul; 14: NTC. 6 ul DNA fra de totale 20 ul eluentene ble lagt på agarosegel. |
A-1 mal
■ Malen inneholder proteinforurensninger eller Taq -hemmere, etc. —— Rens DNA -malen, fjern proteinforurensninger eller ekstraher mal -DNA med rensingssett.
■ Denatureringen av malen er ikke fullført —— Øk denatureringstemperaturen passende og forleng denatureringstiden.
■ Nedbrytning av maler —— Klargjør malen på nytt.
A-2 Primer
■ Dårlig kvalitet på primere —— Syntetiser primeren på nytt.
■ Nedbrytning av primer —— Del væskene med høy konsentrasjon i lite volum for konservering. Unngå å fryse og tine flere ganger eller ved langvarig 4 ° C kryokonservering.
■ Ukorrekt utforming av primere (f.eks. Primerlengde ikke tilstrekkelig, dimer dannet mellom primere, etc.) -Resign primere (unngå dannelse av primer dimer og sekundær struktur)
A-3 mg2+konsentrasjon
■ Mg2+ konsentrasjonen er for lav —— Riktig økning av Mg2+ konsentrasjon: Optimaliser Mg2+ konsentrasjon ved en rekke reaksjoner fra 1 mM til 3 mM med et intervall på 0,5 mM for å bestemme den optimale Mg2+ konsentrasjon for hver mal og primer.
A-4 Utglødningstemperatur
■ Den høye glødetemperaturen påvirker bindingen av primer og mal. —— Reduser glødetemperaturen og optimaliser tilstanden med en gradient på 2 ° C.
A-5 Forlengelsestid
■ Kort forlengelsestid —— Øk forlengelsestiden.
Fenomener: Negative prøver viser også målsekvensbåndene.
A-1 Forurensning av PCR
■ Kryssforurensning av målsekvens eller forsterkningsprodukter —— Forsiktig å ikke pipette prøven som inneholder målsekvensen i den negative prøven eller søl dem ut av sentrifugerøret. Reagensene eller utstyret bør autoklaveres for å eliminere eksisterende nukleinsyrer, og forekomsten av forurensning bør bestemmes gjennom negative kontrollforsøk.
■ Reagensforurensning —— Alikvoter reagensene og oppbevar ved lav temperatur.
A-2 Primer
■ Mg2+ konsentrasjonen er for lav —— Riktig økning av Mg2+ konsentrasjon: Optimaliser Mg2+ konsentrasjon ved en rekke reaksjoner fra 1 mM til 3 mM med et intervall på 0,5 mM for å bestemme den optimale Mg2+ konsentrasjon for hver mal og primer.
■ Feil primerutforming, og målsekvensen har homologi med ikke-målsekvensen. —— Re-design primere.
Fenomener: PCR-forsterkningsbåndene er uforenlige med den forventede størrelsen, enten store eller små, eller noen ganger oppstår både spesifikke forsterkningsbånd og uspesifikke forsterkningsbånd.
A-1 Primer
■ Dårlig primerspesifisitet
—— Re-design primer.
■ Grunnkonsentrasjonen er for høy —— Øk denatureringstemperaturen riktig og forleng denatureringstiden.
A-2 mg2+ konsentrasjon
■ Mg2+ konsentrasjonen er for høy —— Reduser Mg2+ -konsentrasjonen riktig: Optimaliser Mg2+ konsentrasjon ved en rekke reaksjoner fra 1 mM til 3 mM med et intervall på 0,5 mM for å bestemme den optimale Mg2+ konsentrasjon for hver mal og primer.
A-3 termostabil polymerase
■ Overdreven enzymmengde —— Reduser enzymmengden på passende måte med intervaller på 0,5 U.
A-4 Utglødningstemperatur
■ Glødningstemperaturen er for lav —— Øk glødetemperaturen på riktig måte, eller bruk to-trinns glødemetode
A-5 PCR-sykluser
■ For mange PCR -sykluser —— Reduser antallet PCR -sykluser.
A-1 Primer——Dårlig spesifisitet ——Resign primeren, endre posisjonen og lengden på primeren for å forbedre dens spesifisitet; eller utføre nestet PCR.
A-2 Mal-DNA
——Malen er ikke ren —— Rens malen eller ekstraher DNA med rensesett.
A-3 mg2+ konsentrasjon
——Mg2+ konsentrasjonen er for høy —— Reduser Mg riktig2+ konsentrasjon: Optimaliser Mg2+ konsentrasjon ved en rekke reaksjoner fra 1 mM til 3 mM med et intervall på 0,5 mM for å bestemme den optimale Mg2+ konsentrasjon for hver mal og primer.
A-4 dNTP
—— Konsentrasjonen av dNTP er for høy —— Reduser konsentrasjonen av dNTP på riktig måte
A-5 Utglødningstemperatur
—— For lav glødetemperatur —— Øk glødetemperaturen passende
A-6 sykluser
—— For mange sykluser —— Optimaliser syklusnummeret

Det første trinnet er å velge riktig polymerase. Vanlig Taq-polymerase kan ikke korrekturleses på grunn av mangel på 3'-5 'eksonukleaseaktivitet, og mismatch vil i stor grad redusere forlengelseseffektiviteten til fragmenter. Derfor kan vanlig Taq -polymerase ikke effektivt amplifisere målfragmenter større enn 5 kb. Taq -polymerase med spesiell modifikasjon eller annen high fidelity -polymerase bør velges for å forbedre forlengelseseffektiviteten og dekke behovene til lang fragmentforsterkning. I tillegg krever forsterkningen av lange fragmenter også tilsvarende justering av primerdesign, denatureringstid, forlengelsestid, buffer-pH, etc. Vanligvis kan primere med 18-24 bp føre til bedre utbytte. For å forhindre malskade, bør denatureringstiden ved 94 ° C reduseres til 30 sekunder eller mindre per syklus, og tiden for å stige temperaturen til 94 ° C før forsterkning bør være mindre enn 1 min. Videre kan innstilling av forlengelsestemperaturen til omtrent 68 ° C og utforming av forlengelsestiden i henhold til hastigheten på 1 kb/min sikre effektiv forsterkning av lange fragmenter.
Feilraten for PCR -forsterkning kan reduseres ved å bruke forskjellige DNA -polymeraser med høy kvalitet. Blant alle Taq DNA -polymerasene som er funnet så langt, har Pfu -enzymet den laveste feilraten og den høyeste troverdigheten (se vedlagte tabell). I tillegg til enzymvalg kan forskere ytterligere redusere PCR -mutasjonshastigheten ved å optimalisere reaksjonsbetingelsene, inkludert optimalisering av buffersammensetning, konsentrasjon av termostabil polymerase og optimalisering av PCR -syklusnummer.
Produktkategorier
HVORFOR VELGE OSS
Siden etableringen har fabrikken utviklet produkter i førsteklasses klasse med prinsippet
av kvalitet først. Våre produkter har fått et godt rykte i bransjen og er verdifulle blant nye og gamle kunder.








