Blood Direct PCR -sett
Funksjoner
■ Enkel og rask: PCR -forsterkning kan utføres direkte ved hjelp av blod som mal, uten at det er nødvendig med de kjedelige trinnene i prøveforberedelse og DNA -ekstraksjon.
■ Høy renhet: Hopp over prøveforbehandling og DNA-ekstraksjonstrinn kan bidra til å unngå krysskontaminering av prøver.
■ Høy gjennomstrømning: PCR-identifikasjonen for store prøver kan utføres ved å kombinere settet med 96/384-brønns PCR-plater.
■ Sterk universalitet: Dette settet kan effektivt forsterke høye GC -fragmenter eller fragmenter med kompleks sekundær struktur, og forsterkningslengden kan være opptil 5 kb.
■ Sterk belastningsmotstand: Dette settet kan brukes på forskjellige arter og blodprøver som er bevart på forskjellige måter.
applikasjoner
PCR-produktene i dette settet inneholder “A” i 3′-enden, som kan brukes direkte for TA-vektorkloning. Dette settet kan brukes til amplifikasjon av genomiske DNA-fragmenter, genetisk analyse med høy gjennomstrømning og genotyping (for eksempel gendeteksjon) analyse.
Alle produktene kan tilpasses for ODM/OEM. For detaljer,vennligst klikk på Tilpasset service (ODM/OEM)
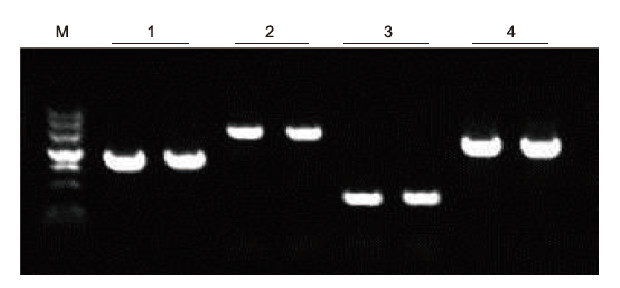 |
Ved bruk av human EDTA antikoagulasjon som en mal, ble 4 gener med forskjellig GC -innhold forsterket av Blood Direct PCR Kit. PCR -reaksjonssystemet var 20 ul, og 1 ul blod ble brukt som mal. M: TIANGEN Marker II; 1: Fragmentstørrelse 1090 bp, GC -innhold 68,1%; 2: Fragmentstørrelse 1915 bp, GC -innhold 70,4%; 3: Fragmentstørrelse 448 bp, GC -innhold 74,8%; 4: Fragmentstørrelse 1527 bp, GC -innhold 61,5%. Eksperimentelle resultater: Blood Direct PCR Kit kan effektivt amplifisere DNA-fragmenter med GC-innholdet i området 61,5%-74,8%, noe som tyder på at det er i stand til å forsterke fragmenter med høy GC. |
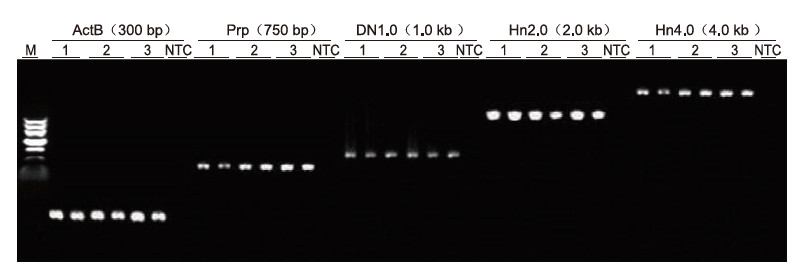 |
Ved bruk av human EDTA antikoagulasjon som mal ble 5 gener med forskjellige lengder (ActB, Prp, DN1.0, Hn2.0 og Hn4.0) forsterket med Blood Direct PCR Kit. PCR -reaksjonssystemet var 20 ul, og 1 ul blod ble brukt som mal. M: TIANGEN Marker II; 1-3: 3 forskjellige blodprøver; NTC: kontroll uten primere. Eksperimentelle resultater: Blood Direct PCR -settet kan forsterke fragmenter med en lengde på opptil 4 kb, noe som tyder på at det er i stand til å forsterke lange fragmenter. |
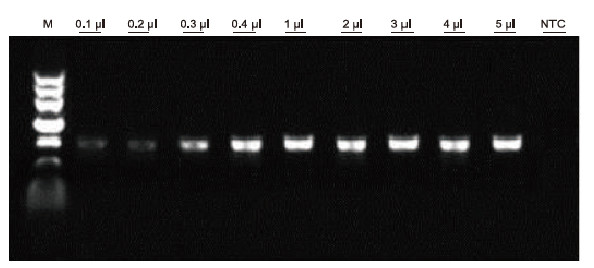 |
Ved å bruke human EDTA antikoagulasjon som mal, ble Blood Direct PCR Kit brukt til PCR -påvisning av forskjellige blodprøver. PCR -reaksjonssystemet var 20 ul, og 1 ul blod ble brukt som mal. M: TIANGEN Marker II; 1-9: mengden blod er henholdsvis 0,1 ul, 0,2 ul, 0,3 ul, 0,4 ul, 1 ul, 2 ul, 3 ul, 4 ul og 5 ul. NTC: kontroll uten mal Eksperimentelle resultater: Blood Direct PCR-settet har sterk motstand mot blod og kan forsterke blodprøver med et lastområde på 0,1-5 μl. |
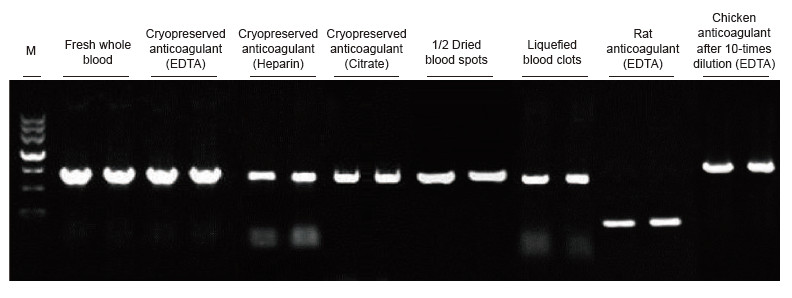 |
Blodprøver fra mennesker, rotter, kyllinger og andre arter med forskjellige behandlinger ble brukt som maler. Blood Direct PCR Kit ble brukt til å forsterke PRNP (human, 750 bp), Actin (rotte, 200 bp) og β-Actin (Chicken, 1,0 kb). PCR -reaksjonssystemet var 20 ul, og 1 ul blod ble brukt som mal. M: TIANGEN Marker II. Eksperimentelle resultater: Blood Direct PCR Kit kan brukes på et bredt spekter av prøver, og direkte PCR -deteksjon kan utføres på blodprøver fra forskjellige arter med forskjellige behandlinger. |
A-1 mal
■ Malen inneholder proteinforurensninger eller Taq -hemmere, etc. —— Rens DNA -malen, fjern proteinforurensninger eller ekstraher mal -DNA med rensingssett.
■ Denatureringen av malen er ikke fullført —— Øk denatureringstemperaturen passende og forleng denatureringstiden.
■ Nedbrytning av maler —— Klargjør malen på nytt.
A-2 Primer
■ Dårlig kvalitet på primere —— Syntetiser primeren på nytt.
■ Nedbrytning av primer —— Del væskene med høy konsentrasjon i lite volum for konservering. Unngå å fryse og tine flere ganger eller ved langvarig 4 ° C kryokonservering.
■ Ukorrekt utforming av primere (f.eks. Primerlengde ikke tilstrekkelig, dimer dannet mellom primere, etc.) -Resign primere (unngå dannelse av primer dimer og sekundær struktur)
A-3 mg2+konsentrasjon
■ Mg2+ konsentrasjonen er for lav —— Riktig økning av Mg2+ konsentrasjon: Optimaliser Mg2+ konsentrasjon ved en rekke reaksjoner fra 1 mM til 3 mM med et intervall på 0,5 mM for å bestemme den optimale Mg2+ konsentrasjon for hver mal og primer.
A-4 Utglødningstemperatur
■ Den høye glødetemperaturen påvirker bindingen av primer og mal. —— Reduser glødetemperaturen og optimaliser tilstanden med en gradient på 2 ° C.
A-5 Forlengelsestid
■ Kort forlengelsestid —— Øk forlengelsestiden.
Fenomener: Negative prøver viser også målsekvensbåndene.
A-1 Forurensning av PCR
■ Kryssforurensning av målsekvens eller forsterkningsprodukter —— Forsiktig å ikke pipette prøven som inneholder målsekvensen i den negative prøven eller søl dem ut av sentrifugerøret. Reagensene eller utstyret bør autoklaveres for å eliminere eksisterende nukleinsyrer, og forekomsten av forurensning bør bestemmes gjennom negative kontrollforsøk.
■ Reagensforurensning —— Alikvoter reagensene og oppbevar ved lav temperatur.
A-2 Primer
■ Mg2+ konsentrasjonen er for lav —— Riktig økning av Mg2+ konsentrasjon: Optimaliser Mg2+ konsentrasjon ved en rekke reaksjoner fra 1 mM til 3 mM med et intervall på 0,5 mM for å bestemme den optimale Mg2+ konsentrasjon for hver mal og primer.
■ Feil primerutforming, og målsekvensen har homologi med ikke-målsekvensen. —— Re-design primere.
Fenomener: PCR-forsterkningsbåndene er uforenlige med den forventede størrelsen, enten store eller små, eller noen ganger oppstår både spesifikke forsterkningsbånd og uspesifikke forsterkningsbånd.
A-1 Primer
■ Dårlig primerspesifisitet
—— Re-design primer.
■ Grunnkonsentrasjonen er for høy —— Øk denatureringstemperaturen riktig og forleng denatureringstiden.
A-2 mg2+ konsentrasjon
■ Mg2+ konsentrasjonen er for høy —— Reduser Mg2+ -konsentrasjonen riktig: Optimaliser Mg2+ konsentrasjon ved en rekke reaksjoner fra 1 mM til 3 mM med et intervall på 0,5 mM for å bestemme den optimale Mg2+ konsentrasjon for hver mal og primer.
A-3 termostabil polymerase
■ Overdreven enzymmengde —— Reduser enzymmengden på passende måte med intervaller på 0,5 U.
A-4 Utglødningstemperatur
■ Glødningstemperaturen er for lav —— Øk glødetemperaturen på riktig måte, eller bruk to-trinns glødemetode
A-5 PCR-sykluser
■ For mange PCR -sykluser —— Reduser antallet PCR -sykluser.
A-1 Primer——Dårlig spesifisitet ——Resign primeren, endre posisjonen og lengden på primeren for å forbedre dens spesifisitet; eller utføre nestet PCR.
A-2 Mal-DNA
——Malen er ikke ren —— Rens malen eller ekstraher DNA med rensesett.
A-3 mg2+ konsentrasjon
——Mg2+ konsentrasjonen er for høy —— Reduser Mg riktig2+ konsentrasjon: Optimaliser Mg2+ konsentrasjon ved en rekke reaksjoner fra 1 mM til 3 mM med et intervall på 0,5 mM for å bestemme den optimale Mg2+ konsentrasjon for hver mal og primer.
A-4 dNTP
—— Konsentrasjonen av dNTP er for høy —— Reduser konsentrasjonen av dNTP på riktig måte
A-5 Utglødningstemperatur
—— For lav glødetemperatur —— Øk glødetemperaturen passende
A-6 sykluser
—— For mange sykluser —— Optimaliser syklusnummeret

Det første trinnet er å velge riktig polymerase. Vanlig Taq-polymerase kan ikke korrekturleses på grunn av mangel på 3'-5 'eksonukleaseaktivitet, og mismatch vil i stor grad redusere forlengelseseffektiviteten til fragmenter. Derfor kan vanlig Taq -polymerase ikke effektivt amplifisere målfragmenter større enn 5 kb. Taq -polymerase med spesiell modifikasjon eller annen high fidelity -polymerase bør velges for å forbedre forlengelseseffektiviteten og dekke behovene til lang fragmentforsterkning. I tillegg krever forsterkningen av lange fragmenter også tilsvarende justering av primerdesign, denatureringstid, forlengelsestid, buffer-pH, etc. Vanligvis kan primere med 18-24 bp føre til bedre utbytte. For å forhindre malskade, bør denatureringstiden ved 94 ° C reduseres til 30 sekunder eller mindre per syklus, og tiden for å stige temperaturen til 94 ° C før forsterkning bør være mindre enn 1 min. Videre kan innstilling av forlengelsestemperaturen til omtrent 68 ° C og utforming av forlengelsestiden i henhold til hastigheten på 1 kb/min sikre effektiv forsterkning av lange fragmenter.
Feilraten for PCR -forsterkning kan reduseres ved å bruke forskjellige DNA -polymeraser med høy kvalitet. Blant alle Taq DNA -polymerasene som er funnet så langt, har Pfu -enzymet den laveste feilraten og den høyeste troverdigheten (se vedlagte tabell). I tillegg til enzymvalg kan forskere ytterligere redusere PCR -mutasjonshastigheten ved å optimalisere reaksjonsbetingelsene, inkludert optimalisering av buffersammensetning, konsentrasjon av termostabil polymerase og optimalisering av PCR -syklusnummer.
Produktkategorier
HVORFOR VELGE OSS
Siden etableringen har fabrikken utviklet produkter i førsteklasses klasse med prinsippet
av kvalitet først. Våre produkter har fått et godt rykte i bransjen og er verdifulle blant nye og gamle kunder.








