2 × Taq PCR MasterMix Ⅱ
Funksjoner
■ Høy forsterkningseffektivitet: DNA -fragmenter i forskjellige størrelser (lavere enn 5 kb) og kilder kan forsterkes effektivt.
■ Høy følsomhet: Så lite som 10 pg målfragmenter kan forsterkes fra genomiske maler.
■ Høy belastningsmotstand: For maler med høyt urenhetsinnhold, for eksempel grovekstrakt mal/bakteriekultur, kan målfragmentet enkelt forsterkes. Polymeraseaktiviteten vil ikke bli påvirket av gjentatt frysing og tining.
■ Praktisk for bruk: Reaksjonssystemet ble forberedt enkelt og raskt. Det forsterkede fragmentet inneholder 3'-ende dA-overheng, som er praktisk for TA-kloning.
Spesifikasjon
Type: Taq DNA -polymerase
Prøve: Renset/grov-ekstrahert mal/bakteriekultur
Mal: > 10 sider
Fragmentstørrelse: <5 kb
Applikasjoner: PCR-amplifikasjon av DNA-fragmenter, DNA-merking, primer-forlengelse, sekvensbestemmelse, storskala gen-deteksjon, semi-kvantitative PCR-eksperimenter, påvisning av spor-DNA, etc.
Alle produktene kan tilpasses for ODM/OEM. For detaljer,vennligst klikk på Tilpasset service (ODM/OEM)
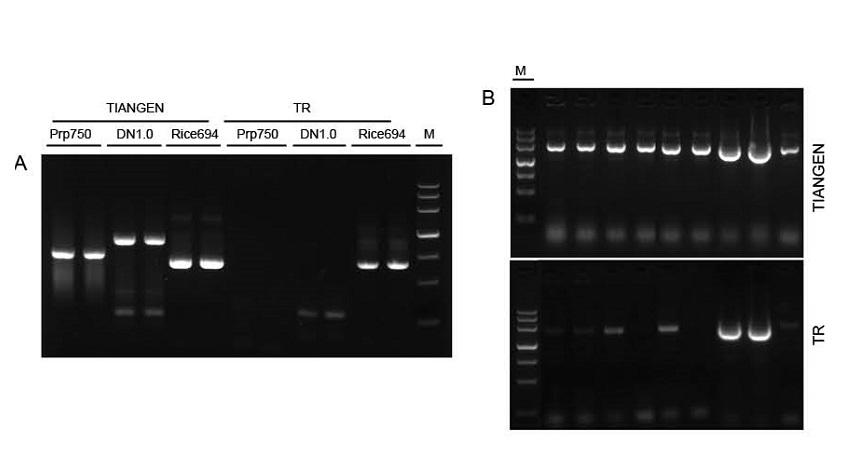 |
Figur 1. Maler fra forskjellige kilder ble forsterket av henholdsvis TIANGEN Taq MasterMix II og den vanlige Taq -blandingen fra Supplier TR for å detektere reagensens spenningsmotstand. Resultatene viser at TIANGEN -produkter kan forsterke målfragmentene fra rå genomiske maler og bakteriekultur, og stressmotstanden er bedre enn for leverandør TR. A: Rå genomisk mal ekstrahert av TIANGEN TIANcombi DNA Lyse & Det PCR Kit. Prp/DN: Rå ekstraksjon og påvisning av humane blodprøver. Ris: Rå utvinning og påvisning av risprøver. B: Koloni PCR. PCR -fragmentet er 700 bp. M: TIANGEN Marker III |
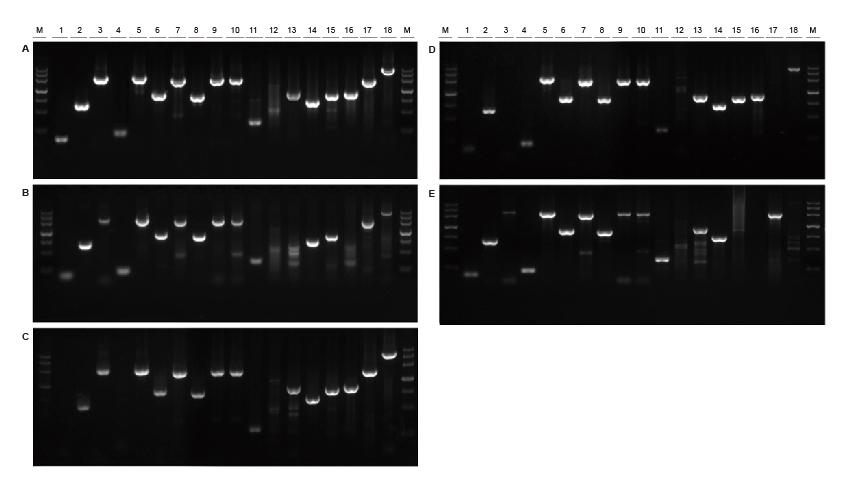 |
God universalitet for maler fra forskjellige kilder og med forskjellige lengder Figur 2. Fragmenter av forskjellige kilder og lengder ble forsterket ved bruk av TIANGEN Taq MasterMix II (A) og vanlig Taq Blanding av henholdsvis Supplier TK (B), Supplier TR (C), Supplier V (D) og Supplier G (E). Resultatene viser at den omfattende ytelsen til TIANGEN -produkter er den beste når det gjelder forsterkningsevne, spesifisitet og universalitet.M: TIANGEN Marker III1: Soybean genomic DNA template (120 bp); 2-3: Ris genomisk DNA-mal (694 bp, 2258 bp); 4: Bomulls genomisk DNA -mal (200 bp); 5: Escherichia coli genomisk DNA -mal (2298 bp); 6-7: Musgenoms DNA-mal (1 kb, 2 kb); 8-10: Rotte genomisk DNA-mal (1 kb, 2 kb, 2080 bp); 11-18: Menneskelig DNA-mal (300 bp, 448 bp (GC%: 74,8%), 1100 bp, 750 bp, 1000 bp, 1090 bp (GC%: 70,4%), 2 kb, 4 kb) |
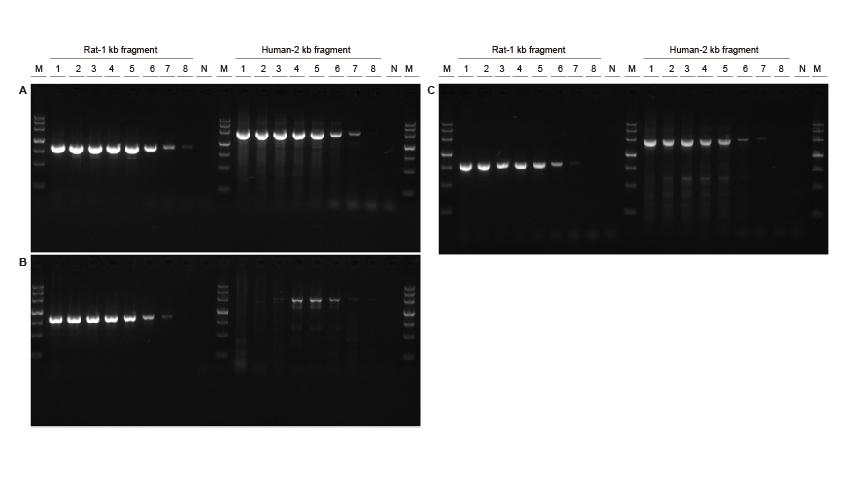 |
Høy følsomhet Figur 3. Ulike konsentrasjoner av rotte- og humane DNA -fragmenter ble forsterket ved bruk av TIANGEN Taq MasterMix II (A), vanlig Taq Blanding av henholdsvis leverandør V (B) og leverandør TK (C) for å oppdage forsterkningsfølsomheten. Resultatene viser at TIANGEN-produktet kan forsterke målfragmentet fra genommalen så lavt som 0,01 ng, og sensitiviteten er bedre enn produktene fra leverandør V og TK.M: TIANGEN Marker III, N: NTC : 200 ng, 100 ng, 50 ng, 20 ng, 10 ng, 1 ng, 0,1 ng, 0,01 ng. |
A-1 mal
■ Malen inneholder proteinforurensninger eller Taq -hemmere, etc. —— Rens DNA -malen, fjern proteinforurensninger eller ekstraher mal -DNA med rensingssett.
■ Denatureringen av malen er ikke fullført —— Øk denatureringstemperaturen passende og forleng denatureringstiden.
■ Nedbrytning av maler —— Klargjør malen på nytt.
A-2 Primer
■ Dårlig kvalitet på primere —— Syntetiser primeren på nytt.
■ Nedbrytning av primer —— Del væskene med høy konsentrasjon i lite volum for konservering. Unngå å fryse og tine flere ganger eller ved langvarig 4 ° C kryokonservering.
■ Ukorrekt utforming av primere (f.eks. Primerlengde ikke tilstrekkelig, dimer dannet mellom primere, etc.) -Resign primere (unngå dannelse av primer dimer og sekundær struktur)
A-3 mg2+konsentrasjon
■ Mg2+ konsentrasjonen er for lav —— Riktig økning av Mg2+ konsentrasjon: Optimaliser Mg2+ konsentrasjon ved en rekke reaksjoner fra 1 mM til 3 mM med et intervall på 0,5 mM for å bestemme den optimale Mg2+ konsentrasjon for hver mal og primer.
A-4 Utglødningstemperatur
■ Den høye glødetemperaturen påvirker bindingen av primer og mal. —— Reduser glødetemperaturen og optimaliser tilstanden med en gradient på 2 ° C.
A-5 Forlengelsestid
■ Kort forlengelsestid —— Øk forlengelsestiden.
Fenomener: Negative prøver viser også målsekvensbåndene.
A-1 Forurensning av PCR
■ Kryssforurensning av målsekvens eller forsterkningsprodukter —— Forsiktig å ikke pipette prøven som inneholder målsekvensen i den negative prøven eller søl dem ut av sentrifugerøret. Reagensene eller utstyret bør autoklaveres for å eliminere eksisterende nukleinsyrer, og forekomsten av forurensning bør bestemmes gjennom negative kontrollforsøk.
■ Reagensforurensning —— Alikvoter reagensene og oppbevar ved lav temperatur.
A-2 Primer
■ Mg2+ konsentrasjonen er for lav —— Riktig økning av Mg2+ konsentrasjon: Optimaliser Mg2+ konsentrasjon ved en rekke reaksjoner fra 1 mM til 3 mM med et intervall på 0,5 mM for å bestemme den optimale Mg2+ konsentrasjon for hver mal og primer.
■ Feil primerutforming, og målsekvensen har homologi med ikke-målsekvensen. —— Re-design primere.
Fenomener: PCR-forsterkningsbåndene er uforenlige med den forventede størrelsen, enten store eller små, eller noen ganger oppstår både spesifikke forsterkningsbånd og uspesifikke forsterkningsbånd.
A-1 Primer
■ Dårlig primerspesifisitet
—— Re-design primer.
■ Grunnkonsentrasjonen er for høy —— Øk denatureringstemperaturen riktig og forleng denatureringstiden.
A-2 mg2+ konsentrasjon
■ Mg2+ konsentrasjonen er for høy —— Reduser Mg2+ -konsentrasjonen riktig: Optimaliser Mg2+ konsentrasjon ved en rekke reaksjoner fra 1 mM til 3 mM med et intervall på 0,5 mM for å bestemme den optimale Mg2+ konsentrasjon for hver mal og primer.
A-3 termostabil polymerase
■ Overdreven enzymmengde —— Reduser enzymmengden på passende måte med intervaller på 0,5 U.
A-4 Utglødningstemperatur
■ Glødningstemperaturen er for lav —— Øk glødetemperaturen på riktig måte, eller bruk to-trinns glødemetode
A-5 PCR-sykluser
■ For mange PCR -sykluser —— Reduser antallet PCR -sykluser.
A-1 Primer——Dårlig spesifisitet ——Resign primeren, endre posisjonen og lengden på primeren for å forbedre dens spesifisitet; eller utføre nestet PCR.
A-2 Mal-DNA
——Malen er ikke ren —— Rens malen eller ekstraher DNA med rensesett.
A-3 mg2+ konsentrasjon
——Mg2+ konsentrasjonen er for høy —— Reduser Mg riktig2+ konsentrasjon: Optimaliser Mg2+ konsentrasjon ved en rekke reaksjoner fra 1 mM til 3 mM med et intervall på 0,5 mM for å bestemme den optimale Mg2+ konsentrasjon for hver mal og primer.
A-4 dNTP
—— Konsentrasjonen av dNTP er for høy —— Reduser konsentrasjonen av dNTP på riktig måte
A-5 Utglødningstemperatur
—— For lav glødetemperatur —— Øk glødetemperaturen passende
A-6 sykluser
—— For mange sykluser —— Optimaliser syklusnummeret

Det første trinnet er å velge riktig polymerase. Vanlig Taq-polymerase kan ikke korrekturleses på grunn av mangel på 3'-5 'eksonukleaseaktivitet, og mismatch vil i stor grad redusere forlengelseseffektiviteten til fragmenter. Derfor kan vanlig Taq -polymerase ikke effektivt amplifisere målfragmenter større enn 5 kb. Taq -polymerase med spesiell modifikasjon eller annen high fidelity -polymerase bør velges for å forbedre forlengelseseffektiviteten og dekke behovene til lang fragmentforsterkning. I tillegg krever forsterkningen av lange fragmenter også tilsvarende justering av primerdesign, denatureringstid, forlengelsestid, buffer-pH, etc. Vanligvis kan primere med 18-24 bp føre til bedre utbytte. For å forhindre malskade, bør denatureringstiden ved 94 ° C reduseres til 30 sekunder eller mindre per syklus, og tiden for å stige temperaturen til 94 ° C før forsterkning bør være mindre enn 1 min. Videre kan innstilling av forlengelsestemperaturen til omtrent 68 ° C og utforming av forlengelsestiden i henhold til hastigheten på 1 kb/min sikre effektiv forsterkning av lange fragmenter.
Feilraten for PCR -forsterkning kan reduseres ved å bruke forskjellige DNA -polymeraser med høy kvalitet. Blant alle Taq DNA -polymerasene som er funnet så langt, har Pfu -enzymet den laveste feilraten og den høyeste troverdigheten (se vedlagte tabell). I tillegg til enzymvalg kan forskere ytterligere redusere PCR -mutasjonshastigheten ved å optimalisere reaksjonsbetingelsene, inkludert optimalisering av buffersammensetning, konsentrasjon av termostabil polymerase og optimalisering av PCR -syklusnummer.
Produktkategorier
HVORFOR VELGE OSS
Siden etableringen har fabrikken utviklet produkter i førsteklasses klasse med prinsippet
av kvalitet først. Våre produkter har fått et godt rykte i bransjen og er verdifulle blant nye og gamle kunder.








