TIANSeq enkeltindeksadapter (Illumina)
Funksjoner
■ Praktisk: SetA og SetB leverer begge 24 enkeltindekser, som kan velges fritt i henhold til kravene.
■ Enkel å bruke: Settet er utstyrt med adapterfortynningsbuffer, som har sterk stabilitet og kan brukes direkte til fortynning av adapterløsninger.
■ Kvalitetskontroll: Streng kvalitetskontroll og funksjonell verifisering mellom batchene sikrer nøyaktigheten av indekssekvensen.
applikasjoner
1. Dette produktet brukes til konstruksjon av DNA- og RNA-biblioteker for Illumina high-throughput sequencing-plattform ved bruk av neste generasjons sekvensering (NGS).
2. Spesifikke anvendelser av produktet inkluderer hele eksonsekvensering, målrettet sekvensering, RNA-Seq, ChIP-Seq, rettet sekvensering og hele genom-sekvensering.
3. Det bør bemerkes at dette produktet ikke er egnet for metyleringsrelatert sekvensering.
Adapter sekvensinformasjon
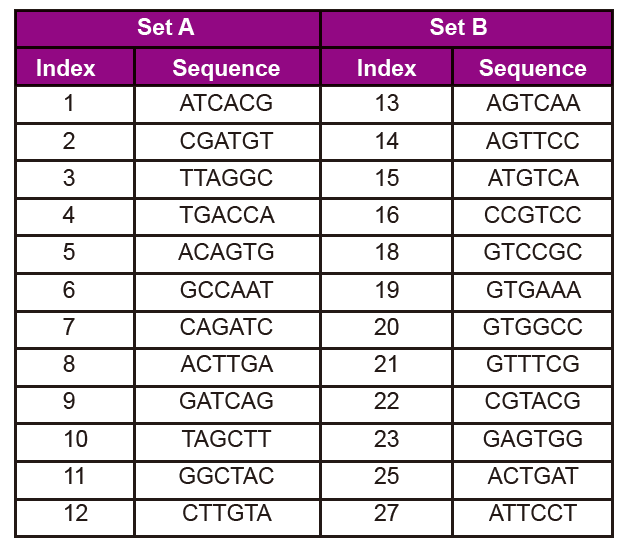
Adapter -sekvensen inneholder følgende informasjon:
1. Universell sekvens
5'-AATGATACGGCGACCACCGAGATCTACACTCTTTCCCT
ACACGACGCTCTTCCGATCT-3 '
2. Indeks inkludert sekvens
5'-GATCGGAAGAGCACACGTCTGAACTCCAGTCAC [indeks1-27] ATCTCGTATGCCGTCTTCTGCTTG-3 '
3. Indeksnummer og sekvens
Alle produktene kan tilpasses for ODM/OEM. For detaljer,vennligst klikk på Tilpasset service (ODM/OEM)
For tiden er sekvenseringsteknologi med høy gjennomstrømning hovedsakelig basert på neste generasjons sekvenseringsteknologi. Siden leselengden til neste generasjons sekvenseringsteknologi er begrenset, må vi dele sekvensen i full lengde i små fragmentbiblioteker for å sekvensere. I henhold til behovene til forskjellige sekvenseringseksperimenter, velger vi vanligvis enkeltsekvensering eller dobbeltsekvensering. For tiden er DNA-fragmentene fra neste generasjons sekvenseringsbibliotek generelt fordelt i området 200-800 bp.

a) DNA har dårlig kvalitet og inneholder hemmere. Bruk DNA-prøver av høy kvalitet for å unngå hemming av enzymaktivitet.
b) Mengden DNA-prøve er utilstrekkelig ved bruk av PCR-fri metode for å konstruere DNA-bibliotek. Når innspillingen av det fragmenterte DNA overstiger 50 ng, kan PCR-fri arbeidsflyt utføres selektivt under byggeprosessen av biblioteket. Hvis kopienummeret til biblioteket er for lavt til å sekvenseres direkte, kan DNA -biblioteket forsterkes med PCR etter adapterligeringen.
c) RNA -forurensning fører til unøyaktig initial DNA -kvantifisering RNA -forurensning kan eksistere i renseprosessen av genomisk DNA, noe som kan føre til unøyaktig DNA -kvantifisering og utilstrekkelig DNA -lasting under bibliotekskonstruksjon. RNA kan fjernes ved behandling med RNase.
A-1
a) Små fragmenter (60 bp-120 bp) vises Små fragmenter er vanligvis adapterfragmenter eller dimerer dannet av adaptere. Rensing med Agencourt AMPure XP magnetiske perler kan effektivt fjerne disse adapterfragmentene og sikre sekvenseringskvalitet.
b) Store fragmenter vises i biblioteket etter PCR -amplifikasjon Størrelsen på bibliotekets DNA -fragment vil øke med 120 bp etter at adapteren er ligert. Hvis DNA -fragmentet øker med mer enn 120 bp etter adapterligering, kan det skyldes unormal fragmentforsterkning av overdreven PCR -amplifikasjon. Reduksjon av antall PCR -sykluser kan forhindre situasjonen.
c) Unormal størrelse på bibliotekets DNA -fragmenter etter adapterligering Lengden på adapteren i dette settet er 60 bp. Når de to endene av fragmentet er ligert til adapterne, vil lengden bare øke med 120 bp. Når du bruker en annen adapter enn den som følger med dette settet, må du kontakte leverandøren for å gi relevant informasjon, for eksempel adapterlengde. Sørg for at eksperimentets arbeidsflyt og drift følger trinnene beskrevet i håndboken.
d) Unormal DNA -fragmentstørrelse før adapterligering Årsaken til dette problemet kan skyldes feil reaksjonsbetingelser under DNA -fragmentering. Ulike reaksjonstider bør brukes for forskjellige DNA -innganger. Hvis DNA-inngangen er mer enn 10 ng, anbefaler vi å velge reaksjonstiden på 12 minutter som starttid for optimalisering, og fragmentstørrelsen som produseres på dette tidspunktet er hovedsakelig i området 300-500 bp. Brukere kan øke eller redusere lengden på DNA-fragmenter i 2-4 minutter i henhold til sine egne krav for å optimalisere DNA-fragmentene med den nødvendige størrelsen.
A-2
a) Fragmenteringstiden er ikke optimalisert Hvis det fragmenterte DNA er for lite eller for stort, vennligst se retningslinjene for valg av fragmenteringstid gitt i instruksjonene for å bestemme reaksjonstiden, og bruk dette tidspunktet som en kontroll, i tillegg sette opp en reaksjonssystem for å forlenge eller forkorte 3 minutter for å gjøre mer nøyaktig justering av fragmenteringstiden.
A-3
Unormal størrelsesfordeling av DNA etter fragmenteringsbehandling
a) Feil opptiningsmetode for fragmenteringsreagens, eller hvis reagenset ikke er helt blandet etter tining. Tine 5 × Fragmentation Enzyme Mix -reagenset på is. Når den er tint, bland reagenset jevnt ved forsiktig å bla i bunnen av røret. Vend ikke reagenset!
b) DNA -inngangsprøven inneholder EDTA eller andre forurensninger. Tømming av saltioner og chelateringsmidler i DNA -rensingstrinnet er spesielt viktig for å lykkes med forsøket. Hvis DNA er oppløst i 1 × TE, bruk metoden som er gitt i instruksjonen for å utføre fragmentering. Hvis EDTA -konsentrasjonen i løsningen er usikker, anbefales det å rense DNA og oppløse det i avionisert vann for påfølgende reaksjon.
c) Unøyaktig innledende DNA -kvantifisering Størrelsen på fragmentert DNA er nært beslektet med mengden DNA -input. Før fragmenteringsbehandling er nøyaktig kvantifisering av DNA ved bruk av Qubit, Picogreen og andre metoder avgjørende for å bestemme den eksakte mengden DNA i reaksjonssystemet.
d) Tilberedningen av reaksjonssystemet følger ikke instruksjonene. Fremstillingen av fragmentert reaksjonssystem må utføres på is strengt i henhold til instruksjonene. For å sikre best mulig effekt, bør alle reaksjonskomponenter legges på is og tilberedningen av reaksjonssystemet utføres etter fullstendig avkjøling. Etter at forberedelsen er fullført, blikk eller pipetter for å blande grundig. Ikke virvel!
1. Feil blandemetode (vortex, voldelig svingning, etc.) vil forårsake unormal fordeling av biblioteksfragmenter (som vist i følgende figur), og dermed påvirke kvaliteten på biblioteket. Når du forbereder Fragmentation Mix -reaksjonsløsningen, må du derfor pipette forsiktig opp og ned for å blande, eller bruk fingertuppen for å bla og blande jevnt. Vær forsiktig så du ikke blander det med virvel.

2. DNA med høy renhet må brukes til bibliotekskonstruksjon
■ God DNA -integritet: Elektroforese -båndet er mer enn 30 kb, uten hale
■ OD260/230:> 1,5
■ OD260/280: 1,7-1,9
3. Mengden DNA -innsats må være nøyaktig Det anbefales å bruke Qubit- og PicoGreen -metoder for å kvantifisere DNA, i stedet for Nanodrop.
4. Innholdet av EDTA i DNA -løsning må bestemmes EDTA har stor innflytelse på fragmenteringsreaksjonen. Hvis innholdet i EDTA er høyt, må DNA -rensing utføres før den påfølgende testen.
5. Fragmenteringsreaksjonsløsningen må tilberedes på is. Fragmenteringsprosessen er følsom for reaksjonstemperatur og tid (spesielt etter tilsetning av forsterkning). For å sikre nøyaktigheten av reaksjonstiden, må du forberede reaksjonssystemet på is.
6. Fragmenteringstiden må være nøyaktig. Reaksjonstiden for fragmenteringstrinnet vil direkte påvirke størrelsen på fragmentproduktene, og dermed påvirke størrelsesfordelingen av DNA -fragmenter i biblioteket.
1. Hvilken type prøve gjelder for dette settet?
Den aktuelle prøvetypen til dette settet kan være total RNA eller renset mRNA med god RNA -integritet. Hvis totalt RNA brukes til å konstruere biblioteket, anbefales det å bruke rRNA -tømmingssettet (Cat#4992363/4992364/4992391) for å fjerne rRNA først.
2. Kan FFPE -prøver brukes til å konstruere bibliotek med dette settet?
MRNA i FFPE -prøver vil bli nedbrutt til en viss grad, med relativ dårlig integritet. Når du bruker dette settet til bibliotekskonstruksjonen, anbefales det å optimalisere fragmenteringstiden (forkorte fragmenteringstiden eller ikke utføre fragmentering).
3. Hva kan føre til at det innsatte segmentet ser ut som en liten avvik ved å bruke trinnet for valg av størrelse i produkthåndboken?
Størrelsesvalg skal utføres i strengt samsvar med trinnet for valg av størrelse i denne produkthåndboken. Hvis det er avvik, kan årsaken være at de magnetiske perlene ikke er balansert til romtemperatur eller ikke er helt blandet, pipetten ikke er nøyaktig eller at væsken blir igjen i spissen. Det anbefales å bruke tipsene med lav adsorpsjon for eksperimentet.
4. Valg av adaptere i bibliotekskonstruksjon
Bibliotekets byggesett inneholder ikke adapterreagens, og det anbefales å bruke dette settet sammen med TIANSeq Single-Index Adapter (Illumina) (4992641/4992642/4992378).
5. QC på biblioteket
Bibliotekets kvantitative påvisning: Qubit og qPCR brukes til å bestemme henholdsvis massekonsentrasjon og molarkonsentrasjon av biblioteket. Operasjonen er strengt i samsvar med produktmanualen. Konsentrasjonen av biblioteket vil generelt oppfylle kravene til NGS -sekvensering. Påvisning av biblioteks distribusjonsområde: Ved hjelp av Agilent 2100 Bioanalyzer for å oppdage bibliotekets distribusjonsområde.
6. Valg av forsterkningssyklusnummer
I henhold til instruksjonene er antallet PCR-sykluser 6-12, og antall PCR-sykluser som trengs bør velges i henhold til prøveinngangen. I biblioteker med høy avkastning skjer vanligvis overforsterkning i varierende grad, noe som manifesteres av en litt større topp etter toppen av målområdet ved påvisning av Agilent 2100 Bioanalyzer, eller den oppdagede konsentrasjonen av Qubit er lavere enn for qPCR. Mild over forsterkning er et normalt fenomen, som ikke påvirker bibliotekets sekvensering og påfølgende dataanalyse.
7. Spikes vises i deteksjonsprofilen til Agilent 2100 Bioanalyzer
Utseendet til pigger ved Agilent 2100 Bioanalyzer -deteksjon er på grunn av den ujevne fragmenteringen av prøver, hvor det vil være flere fragmenter i en viss størrelse, og dette vil bli mer tydelig etter PCR -berikelse. I dette tilfellet foreslås det å ikke utføre størrelsesvalget, dvs. sette fragmenteringstilstanden til 94 ° C i 15 minutter inkubert, hvor fragmentfordelingen er liten og konsentrert, og homogeniteten kan forbedres.
Produktkategorier
HVORFOR VELGE OSS
Siden etableringen har fabrikken utviklet produkter i førsteklasses klasse med prinsippet
av kvalitet først. Våre produkter har fått et godt rykte i bransjen og er verdifulle blant nye og gamle kunder.








