2 × Taq Platinum PCR Mix
Aktivitetsdefinisjon
1 enhet (U) Taq Platinum DNA Polymerase-aktivitet er definert som mengden enzym som kreves for å inkorporere 10 nmol deoksynukleotider i syre-uløselige stoffer ved 74 ° C i løpet av 30 minutter ved bruk av aktivert laks-sæd-DNA som mal/primer.
Kvalitetskontroll
Renheten ved SDS-PAGE-deteksjon er mer enn 99%; Det påvises ingen aktivitet av eksogent nuklease; Enkeltkopi-genet i humant genom kan forsterkes effektivt; Ingen signifikant aktivitetsendring når den lagres ved romtemperatur i en uke.
Hovedtekniske parametere
Den har 5'-3'-eksonukleaseaktivitet og 3'-5'-eksonuklease-aktivitet, og dens troskap ligger ved siden av Pfu-polymerase. Forlengelseshastigheten til Taq Platinum Polymerase er raskere enn Pfu -polymerase og forsterkningseffektiviteten er høyere. PCR -produkter kan ligeres direkte til den stumpe enden eller klones med TA -vektor. Hvis kloningseffektiviteten må forbedres, anbefales det å rense først og legge til 3'-dA-overheng før kloning i TA-vektor.
Ett-rør Taq Platinum MasterMix (nasjonal høyteknologisk produktsertifisering)
■ Taq Platinum MasterMix har forbedret spesifisitet og følsomhet for PCR -reaksjon og kan forsterke komplekse maler med høyt GC -innhold, sekundær struktur og lignende. Så lite som 2 kopier av målmalen kan forsterkes, noe som sikrer mer nøyaktige eksperimentelle resultater.
■ Den unike Taq Platinum MasterMix-formelen gjør hele reaksjonssystemet veldig stabilt, og aktiviteten påvirkes ikke av gjentatt fryse-tining eller langtidslagring ved 4 ° C.
■ Den stabile og effektive forhåndsforberedte PCR-blandede løsningen kan gjøre operasjonen rask og enkel, og reduserer arbeidsintensiteten og prøvetakingsfeilen sterkt. Høytytende PCR-forsterker og optimizer er også inkludert i blandingen, noe som reduserer kravene til PCR-forhold.
■ Dette produktet har både fargestoffholdige og fargestofffrie systemer. Fargestoffholdige MasterMix-produkter kan elektroforeseres direkte etter PCR, uten å legge til lastebuffer.
applikasjoner
Det kan erstatte Pfu-polymerase for å forsterke produkter i høy kvalitet fra komplekse maler som genomer, og det er egnet for applikasjoner som kloning av ekspresjonsgener, stedsspesifikke mutasjoner og analyse av enkeltnukleotidpolymorfisme (SNP), etc.
Forholdsregler ved utforming av PCR -primere:
Primerlengden er vanligvis 20-25 mer. Ved utførelse av langt fragment PCR bør imidlertid primerlengden økes til 30-35 mer.
■ Det er ingen komplementær sammenkobling mellom de to primerne, spesielt for de tre siste basene i 3 ′ -enden.
■ GC-innhold bør være 50-60%, og unngå lokal rik GC eller AT. For å få primer og mal til å binde stabilt, unngå AT -rik struktur i 3 ′ enden.
■ Unngå primer for å danne sekundærstruktur.
■ Velg to primere med Tm -temperaturer nær hverandre.
Beregning av Tm -verdien av primere for PCR:
■ Når primeren er mindre enn 20 mer: Tm = 2 ° C × (A+T)+4 ° C × (G+C).
■ Når primeren er mer enn 20 mer: Tm = 81,5+0,41 × (GC%)-600/L, der L er lengden på primeren.
■ Still glødetemperaturen på (Tm-5) ° C.
PCR -primerinngang
Den riktige sluttkonsentrasjonen av primere kan velges mellom 0,1 μM og 1,0 μM. For lav primerkonsentrasjon fører til lavt utbytte av amplifikasjonsprodukter, mens for høy primerkonsentrasjon er mer utsatt for uspesifikk amplifikasjon. Vanligvis, når mengden av mal -DNA er stor eller komplekst mal -DNA (for eksempel humant genom -DNA) brukes som en mal, bør primerkonsentrasjonen være lavere. Når mengden av mal -DNA er liten eller enkelt mal -DNA (f.eks. Plasmid -DNA, etc.) brukes som en mal, bør primerkonsentrasjonen være høyere.
Alle produktene kan tilpasses for ODM/OEM. For detaljer,vennligst klikk på Tilpasset service (ODM/OEM)
 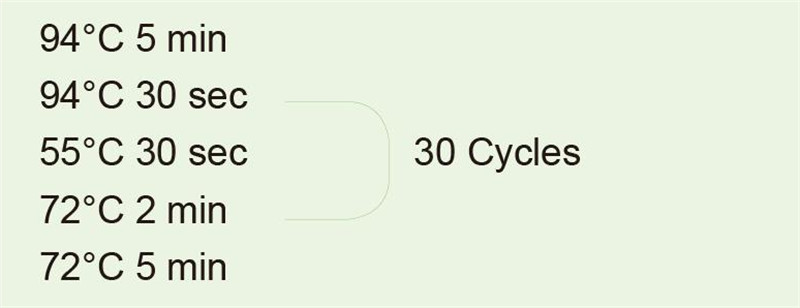 |
Bruk genomisk DNA som mal for å forsterke 1 kb fragment. Etter PCR -reaksjonen, ta 5 ul for elektroforesedeteksjon. |
A-1 mal
■ Malen inneholder proteinforurensninger eller Taq -hemmere, etc. —— Rens DNA -malen, fjern proteinforurensninger eller ekstraher mal -DNA med rensingssett.
■ Denatureringen av malen er ikke fullført —— Øk denatureringstemperaturen passende og forleng denatureringstiden.
■ Nedbrytning av maler —— Klargjør malen på nytt.
A-2 Primer
■ Dårlig kvalitet på primere —— Syntetiser primeren på nytt.
■ Nedbrytning av primer —— Del væskene med høy konsentrasjon i lite volum for konservering. Unngå å fryse og tine flere ganger eller ved langvarig 4 ° C kryokonservering.
■ Ukorrekt utforming av primere (f.eks. Primerlengde ikke tilstrekkelig, dimer dannet mellom primere, etc.) -Resign primere (unngå dannelse av primer dimer og sekundær struktur)
A-3 mg2+konsentrasjon
■ Mg2+ konsentrasjonen er for lav —— Riktig økning av Mg2+ konsentrasjon: Optimaliser Mg2+ konsentrasjon ved en rekke reaksjoner fra 1 mM til 3 mM med et intervall på 0,5 mM for å bestemme den optimale Mg2+ konsentrasjon for hver mal og primer.
A-4 Utglødningstemperatur
■ Den høye glødetemperaturen påvirker bindingen av primer og mal. —— Reduser glødetemperaturen og optimaliser tilstanden med en gradient på 2 ° C.
A-5 Forlengelsestid
■ Kort forlengelsestid —— Øk forlengelsestiden.
Fenomener: Negative prøver viser også målsekvensbåndene.
A-1 Forurensning av PCR
■ Kryssforurensning av målsekvens eller forsterkningsprodukter —— Forsiktig å ikke pipette prøven som inneholder målsekvensen i den negative prøven eller søl dem ut av sentrifugerøret. Reagensene eller utstyret bør autoklaveres for å eliminere eksisterende nukleinsyrer, og forekomsten av forurensning bør bestemmes gjennom negative kontrollforsøk.
■ Reagensforurensning —— Alikvoter reagensene og oppbevar ved lav temperatur.
A-2 Primer
■ Mg2+ konsentrasjonen er for lav —— Riktig økning av Mg2+ konsentrasjon: Optimaliser Mg2+ konsentrasjon ved en rekke reaksjoner fra 1 mM til 3 mM med et intervall på 0,5 mM for å bestemme den optimale Mg2+ konsentrasjon for hver mal og primer.
■ Feil primerutforming, og målsekvensen har homologi med ikke-målsekvensen. —— Re-design primere.
Fenomener: PCR-forsterkningsbåndene er uforenlige med den forventede størrelsen, enten store eller små, eller noen ganger oppstår både spesifikke forsterkningsbånd og uspesifikke forsterkningsbånd.
A-1 Primer
■ Dårlig primerspesifisitet
—— Re-design primer.
■ Grunnkonsentrasjonen er for høy —— Øk denatureringstemperaturen riktig og forleng denatureringstiden.
A-2 mg2+ konsentrasjon
■ Mg2+ konsentrasjonen er for høy —— Reduser Mg2+ -konsentrasjonen riktig: Optimaliser Mg2+ konsentrasjon ved en rekke reaksjoner fra 1 mM til 3 mM med et intervall på 0,5 mM for å bestemme den optimale Mg2+ konsentrasjon for hver mal og primer.
A-3 termostabil polymerase
■ Overdreven enzymmengde —— Reduser enzymmengden på passende måte med intervaller på 0,5 U.
A-4 Utglødningstemperatur
■ Glødningstemperaturen er for lav —— Øk glødetemperaturen på riktig måte, eller bruk to-trinns glødemetode
A-5 PCR-sykluser
■ For mange PCR -sykluser —— Reduser antallet PCR -sykluser.
A-1 Primer——Dårlig spesifisitet ——Resign primeren, endre posisjonen og lengden på primeren for å forbedre dens spesifisitet; eller utføre nestet PCR.
A-2 Mal-DNA
——Malen er ikke ren —— Rens malen eller ekstraher DNA med rensesett.
A-3 mg2+ konsentrasjon
——Mg2+ konsentrasjonen er for høy —— Reduser Mg riktig2+ konsentrasjon: Optimaliser Mg2+ konsentrasjon ved en rekke reaksjoner fra 1 mM til 3 mM med et intervall på 0,5 mM for å bestemme den optimale Mg2+ konsentrasjon for hver mal og primer.
A-4 dNTP
—— Konsentrasjonen av dNTP er for høy —— Reduser konsentrasjonen av dNTP på riktig måte
A-5 Utglødningstemperatur
—— For lav glødetemperatur —— Øk glødetemperaturen passende
A-6 sykluser
—— For mange sykluser —— Optimaliser syklusnummeret

Det første trinnet er å velge riktig polymerase. Vanlig Taq-polymerase kan ikke korrekturleses på grunn av mangel på 3'-5 'eksonukleaseaktivitet, og mismatch vil i stor grad redusere forlengelseseffektiviteten til fragmenter. Derfor kan vanlig Taq -polymerase ikke effektivt amplifisere målfragmenter større enn 5 kb. Taq -polymerase med spesiell modifikasjon eller annen high fidelity -polymerase bør velges for å forbedre forlengelseseffektiviteten og dekke behovene til lang fragmentforsterkning. I tillegg krever forsterkningen av lange fragmenter også tilsvarende justering av primerdesign, denatureringstid, forlengelsestid, buffer-pH, etc. Vanligvis kan primere med 18-24 bp føre til bedre utbytte. For å forhindre malskade, bør denatureringstiden ved 94 ° C reduseres til 30 sekunder eller mindre per syklus, og tiden for å stige temperaturen til 94 ° C før forsterkning bør være mindre enn 1 min. Videre kan innstilling av forlengelsestemperaturen til omtrent 68 ° C og utforming av forlengelsestiden i henhold til hastigheten på 1 kb/min sikre effektiv forsterkning av lange fragmenter.
Feilraten for PCR -forsterkning kan reduseres ved å bruke forskjellige DNA -polymeraser med høy kvalitet. Blant alle Taq DNA -polymerasene som er funnet så langt, har Pfu -enzymet den laveste feilraten og den høyeste troverdigheten (se vedlagte tabell). I tillegg til enzymvalg kan forskere ytterligere redusere PCR -mutasjonshastigheten ved å optimalisere reaksjonsbetingelsene, inkludert optimalisering av buffersammensetning, konsentrasjon av termostabil polymerase og optimalisering av PCR -syklusnummer.
Produktkategorier
HVORFOR VELGE OSS
Siden etableringen har fabrikken utviklet produkter i førsteklasses klasse med prinsippet
av kvalitet først. Våre produkter har fått et godt rykte i bransjen og er verdifulle blant nye og gamle kunder.








